Gehirntheorie der Wirbeltiere
ISBN
978-3-00-064888-5
Monografie von Dr. rer. nat. Andreas Heinrich Malczan
3.19 Die Entwicklung des olfaktorischen Systems
Das olfaktorische System stellte im Strickleitersystem die oberste Etage dar. Sowohl der sensorische Eingangskern, der motorische Ausgangskern sowie alle Mittelwertkerne waren in dieser einen Ebene angeordnet und befanden sich räumlich eng beieinander. Später, als sich die einzelnen Modalitäten in separate Modalitätenschleifen auffalteten, blieb das olfaktorische System innerhalb der Temporalschleife erhalten, denn es war inzwischen eine sehr konservative, evolutionär uralte Struktur, die keine eigene Modalitätenschleife hervorbringen konnte. Es blieb an der Spitze der Temporalschleife als oberste Etage erhalten. Später, mit der räumlichen Ausdehnung aller cortikalen Schleifen, blieb es ein eigenständiger Bestandteil des sich bildenden Temporallappens des Wirbeltiergehirns. Seine verschiedenen Substrukturen bildeten einen Komplex, der als Amygdala bezeichnet wird. Später bildete sich als neue Struktur der Hippocampus aus.
Innerhalb dieses olfaktorischen Systems bildeten sich im Verlaufe der Evolution unterschiedliche Kerne, die nachfolgend beschrieben werden.
Theorem der lateralen Amygdala als Eingangskern
Die laterale Amygdala (basal Nucleus) ist das sensorische Zentrum der olfaktorischen Etage im frühen Strickleitersystem und empfängt sowohl den Input der olfaktorischen Rezeptoren als auch die im Strickleitersystem aufsteigenden Signale der darunterliegenden Etagen. Sie bildet den Eingangskern der olfaktorischen Etage.
Theorem der basalen, parvozellularen Amygdala als Ausgangskern
Der parvozellulare Anteil des basalen Kerns der Amygdala ist das motorische Zentrum der olfaktorischen Etage im frühen Strickleitersystem und sendet den Output absteigend zu den tieferen Etagen, so dass letztlich über den Nucleus ruber die Motoneuronen aktiviert werden können. Er ist der Ausgangskern der olfaktorischen Etage. Seine Neuronen entsprechen den Neuronen der Klasse 5 des Cortex.
Dieses motorische Zentrum des Strickleitersystems projiziert ebenso in die verschiedenen Mittelwertkerne der olfaktorischen Etage und der tieferen Etagen, insbesondere auch in das dopaminerge Mittelwertzentrum, welches seinerseits eine Rückprojektion bewirkt.
Theorem der basalen, magnozellularen Amygdala
Das glutamaterge Mittelwertzentrum der olfaktorischen Etage wird von den magnozellularen Neuronen des basalen Kerns gebildet. Dieser Kern ist funktional vergleichbar mit dem Nucleus subthalamicus unterhalb der thalamischen Etage nach der Aufspaltung der Modalitäten in separate Wendeschleifen.
Theorem des Septums als cholinergem Mittelwertkern
Das Septum bildet das cholinerge Mittelwertzentrum der olfaktorischen Etage im frühen Strickleitersystem und sendet den Output sowohl an die Amygdala als auch an tiefere Substrukturen. Der cholinerge Mittelwertkern der übrigen verschiedenen Modalitäten wird vom Nucleus basalis Meynert gebildet.
Der erste Nachteil des sich entwickelnden olfaktorischen Sinnes war die Vergänglichkeit der olfaktorischen Signale. Sobald die Düfte, die sich auch im Urozean ausbreiteten, nicht mehr wahrnehmbar waren, feuerten die olfaktorischen Rezeptoren nicht mehr. Die schnelle Diffusion sorgte dafür, dass die Duftwolke von Beutetieren oder Fressfeinden schnell verflog. Dann gab es kein olfaktorisches Signal mehr, welches das motorische System aktivieren konnte.
Eine Möglichkeit, die Dauer der olfaktorischen Signale zu verlängern, bestand in der Wiederholung dieser Signale. Die olfaktorischen Signale der Rezeptoren trafen über deren Axone im ersten Segment des frühen Strickleiternervensystems ein und aktivierten dort die Kommissurneuronen der Klasse 3 des sensorischen Zentrums. Sie werden heute als Körnerzellen bezeichnet und projizierten über Kommissuraxone in das motorische Zentrum, welches die basale (parvozellulare) Amygdala bildete. Diese Axone werden heute als Moosfasern bezeichnet. Auf den Moosfasern breiteten sich die generierten Aktionspotentiale relativ langsam aus.
Diese unmyelinisierten Axone, die Moosfasern, wurden im Verlauf der Evolution von vielen neu gebildeten Echoneuronen angezapft, die wir als Ableger der Neuronen der Klasse 3 auffassen können. Und weil eine einzelne Synapse die nötige Erregung gar nicht übertragen konnte, bildeten sich zwischen den Moosfasern und den Echoneuronen hunderte Synapsen aus, indem die Axone und Dendriten stark verzweigte, moosartige Strukturen bildeten. Durch die damit verbundene Erhöhung der Synapsenanzahl konnten die Moosfasersignale in den Echoneuronen Aktionspotentiale generieren. So entstand aus einem einzelnen Aktionspotential eine Folge von Aktionspotentialen. Auf der unmyelinisierten Moosfaser breitete sich das Aktionspotential relativ langsam aus. Und immer, wenn es an einem angeschlossenen Echoneuron vorbeikam, generierte es in dem Echoneuron ebenfalls ein Aktionspotential. Die Echoneuronen hatten anfangs dickere Axone und leiteten die Aktionspotentiale daher mit höherer Geschwindigkeit weiter. Im Verlaufe der Evolution bildeten sie Myelinscheiden aus, wodurch die Ausbreitungsgeschwindigkeit der Aktionspotentiale weiter zunahm. Diese Axone werden heute als Schaffer-Kollateralen bezeichnen. Diese leiteten die Aktionspotentiale einer Moosfaser zu einem gemeinsamen Integrationsneuron. Dieses empfing nun die Folge von Aktionspotentialen von den zugehörigen Echoneuronen der gleichen Moosfaser. Diese trafen wegen der geringeren Ausbreitungsgeschwindigkeit entlang der Moosfaser aber zeitversetzt beim Integrationsneuron ein. Ein olfaktorisches Aktionspotential erzeugte in dieser Struktur eine Folge von aufeinanderfolgenden Aktionspotentialen. Und da jedes Outputneuron des olfaktorischen Sinnes einer eigenen Moosfaser zugeführt wurde, erzeugte das zugehörige Integrationsneuron im Aktivitätsfall eine Aktionspotentialfolge als Antwort auf ein einzelnes Aktionspotential. Die Dauer dieser Aktionspotentialfolge ermögliche es, eine motorische Reaktion auf das olfaktorische Signal zu verlängern. Diese Struktur bildete sich im olfaktorischen Cortex aus und wird als Hippocampus bezeichnet. Parallel zu ihrer Herausbildung kam es durch die damit verbundene Raumforderung zur räumlichen Aufblähung der obersten, also der olfaktorischen Etage des Strickleiternervensystems. Der zugehörige Ventrikelraum wurde dadurch größer.
Abbildung: Echogenerator (Prinzipschaltbild) - Quelle: A. H. Malczan
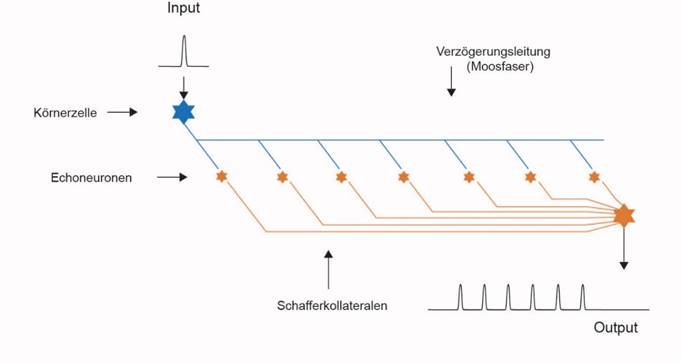
Abbildung 19- Echoerzeugung auf Verzögerungsleitungen im Hippocampus
Der Hippocampus verlängerte die Reaktionsmöglichkeit auf olfaktorische Signale, indem er jedes Aktionspotential in eine längere Folge von Aktionspotentialen überführte. Sein Output erreichte die Amygdala, die in die Motoneuronen projizierte. Im Verlaufe der Evolution bildete sich eine erregende Rückprojektion von der Amygdala zum Hippocampus aus, die eine Punkt-zu-Punkt-Projektion darstellte. Jede Körnerzelle empfing genau den Amygdalaoutput, den sie als Amygdalainput erzeugt hatte. Dadurch kam es zu einer positiven Rückkopplung, in deren Folge ein Rotationsgedächtnis für olfaktorische Signale entstand.
Theorem der Echobildung im Hippocampus
Die olfaktorischen Rezeptorsignale des Cortex führten im Hippocampus zur Erregung von Körnerzellen. Jedes Aktionspotential einer Körnerzelle breitete sich auf ihrem unmyelinisierten Axon mit geringerer Geschwindigkeit aus und generierte bei seiner Ausbreitung in jedem Echoneuron der CA3-Region ebenfalls je ein Aktionspotential. Über die anfangs dickeren, im Verlaufe der Evolution sogar myelinisierten Schaffer-Kollateralen trafen die Aktionspotentiale der Echoneuronen mit einer gewissen Zeitverzögerung in einem gemeinsamen Outputneuron der CA1-Region ein. So entstand aus einem Aktionspotential einer Körnerzelle eine Folge von Aktionspotentialen im zugehörigen Outputneuron der CA1-Region. Dies entsprach einer Frequenzvervielfachung der Feuerrate des Inputs.
Der Output des Hippocampus wurde durch Frequenzvervielfachung aus dem ursprünglichen olfaktorischen Rezeptoroutput erzeugt und generierte daher viel stärkere und länger anhaltende motorische Reaktionen.
Hier entsteht natürlich die Frage, zu welcher evolutionären Zeit die Schaffer-Kollateralen im Hippocampus eine (wenn auch schwache) Myelinhülle bilden konnten. Diese war erforderlich, um die beschriebene Funktion zu perfektionieren.
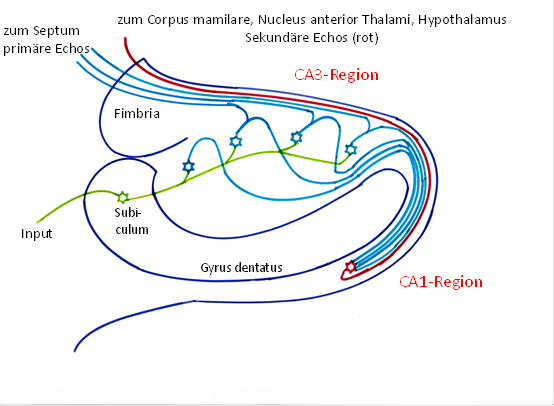
Abbildung 20- Grundschaltung Hippocampus als Echogenerator
Rückkopplungen in neuronalen Strukturen begegnen uns vielfach. Die Rückführung hippocampaler Signale zurück zum Hippocampus erschuf ein Langzeitgedächtnis. Hierzu bedurfte es eines Neuronenkerns, der die Hippocampussignale empfing und zum Hippocampus zurückschickte. Dieser Kern war die Amygdala. Die Amygdala war eine Outputstruktur der olfaktorischen Etage der segmentierten Bilateria, deren Linie zu den Wirbeltieren führte.
Theorem der Amygdala als Rückkopplungs- und Outputstruktur des olfaktorischen Systems
Die Signale des Hippocampus erreichten die Amygdala, die einerseits als Outputkern die motorischen Konnektivneuronen der Klasse 5 aktivierte, die zu den Motoneuronen der Kopfregion und des Rumpfes projizierten. Andererseits projizierte die Amygdala über Kommissurneuronen der Klasse 3 zu den Eingangsneuronen des Hippocampus, so dass es zu einer positiven Rückkopplung kam.
Theorem der Bildung hemmender Interneuronen im Hippocampus und in der Amygdala
Sowohl im Hippocampus als auch in der Amygdala entstanden hemmende Interneuronen, die eine laterale Hemmung bewirkten und so zur Kontrastverstärkung zwischen schwachen und starken Signalen führten.
Theorem der erregenden Projektion des Hippocampus in das Septum
Der Output des Hippocampus erreicht das Septum, welches als Mittelwertzentrum der olfaktorischen Etage dient.
Jedes Mittelwertsystem projiziert in das Ursprungssystem zurück. Der Hippocampus war jedoch durch die Frequenzvervielfachung des olfaktorischen Inputs und die positive Rückkopplung zur Amygdala tonisch erregt. Eine erregende Rückführung der septalen Signale hätte keinen Nutzen gebracht. Daher projizierte das Septum mit seinem erregenden Transmitter Acetylcholin in die hemmenden Interneuronen des Hippocampus und brachte dadurch dessen Erregung kurzzeitig zum Erliegen. Damit empfing es selbst keine hippocampalen Signale mehr, so dass sein Output wegfiel. Da dann aber immer noch erregende Amygdalasignale im Hippocampus eintrafen, begann dessen tonische Erregung erneut. So folgte auf jede kurzzeitige Phase der tonischen Erregung des Hippocampus eine Phase der totalen Hemmung. Diese Schwingungsform des Hippocampus wird als hippocampales Theta bezeichnet. Die hemmenden Interneuronen, die eine laterale Hemmung bewirkten, führten zur Synchronisation dieser Schwingungsform unter den vielen Outputneuronen.

Abbildung 21- Das hippocampale Theta
Theorem der Entstehung des hippocampalen Theta
Das hippocampale Theta hat seine Ursache in der positiven Rückkopplung der Hippocampusschwingung über die Amygdala und der negativen Rückkopplung über das Septum.
Hierbei spielt die Laufzeit der Signale vom Hippocampus zur Amygdala und zurück zum Hippocampus sowie die Laufzeit der Signale vom Hippocampus zum Septum und zurück zum Hippocampus eine große Rolle. Die Frequenz der Schwingung wird jedoch nach oben begrenzt durch die Refraktärzeit der beteiligten Neuronen. Ein Wegfall der septalen Projektion hat dramatische Folgen.
Theorem der Entstehung von epileptischen Anfällen
Der Wegfall der vom Septum über Interneuronen bewirkten periodischen Hemmung der tonischen Dauererregung im Hippocampus führt zu krankhaften Erregungszuständen im hippocampalen System, die sich als epileptische Anfälle bemerkbar machen.
Die Amygdala empfing im Verlaufe der evolutionären Entwicklung neben den olfaktorischen Signalen auch die Signale anderer Modalitäten, unter anderem visuelle. Diese stiegen vom Tectum kopfwärts und erreichten über die aufsteigend projizierenden Konnektivneuronen der Klasse 4 und die waagerechten Kommissurneuronen der Klasse 3 die Amygdala.
In der Amygdala selbst entwickelte sich ein eigenes Mittelwertzentrum und bildete einen selbständigen Kern, der als basale Amygdala bezeichnet wird.
Ein olfaktorisches Signal - später auch ein Signal einer anderen Modalität - welches einen Eingang in das hippocampale System fand, rotierte dauerhaft in der Rückkopplungsschleife zwischen Hippocampus und Amygdala. Dies entsprach einem Langzeitgedächtnis, und das rotierende Signal konnte als Output der Amygdala beispielsweise motorische Reaktionen auslösen. So konnte durch ein kurzzeitig einwirkendes olfaktorisches Signal eine Beutesuche gestartet werden, die durch die Signalrotation ewig anhalten würde. Doch Letzteres war unzweckmäßig. Die Suche musste irgendwann abgebrochen werden. Dies war nur möglich, wenn es Strukturen gab, die ein Abbruchsignal erzeugten, welches die Signalrotation hemmte. Hier war eine zeitgesteuerte Rotationsunterbrechung günstig. Beispielsweise nach 1 Stunde, vielleicht auch nach 2 Stunden, spätestens jedoch, wenn ein neuer Tag begann, wurde die Suche eingestellt und alles auf Anfang gesetzt. Dazu dienten zeitgesteuerte Kerne, etwa der Nucleus suprachiasmaticus. Dieser Kern im ventralen Hypothalamus dient der circadianen Steuerung und war geeignet, ein Zeitsignal zur Hemmung der hippocampalen Rotationen auszusenden. Die Unterbrechung der Rotation erfolgte in hemmenden Neuronen der Amygdala, die das erregende Stoppsignal empfingen und ihrerseits die Amygdalaneuronen hemmten. Diese Neuronen formierten sich später zur zentralen Amygdala, die jedoch im Verlaufe der Evolution weitere Aufgaben wahrnehmen sollte.
Theorem der Unterbrechung der hippocampalen Dauerrotation
Die hemmenden Neuronen, die Stoppsignale empfingen und dadurch die hippocampale Dauerrotation von Signalen unterbrachen, bildeten den zentralen Kern der Amygdala. Sie gingen aus den hemmenden Interneuronen hervor, die in der Amygdala der lateralen Hemmung und damit der Kontrastverstärkung dienten. Später wurden vom zentralen Kern weitere Aufgaben übernommen.
Monografie von Dr. rer. nat. Andreas Heinrich Malczan