Theorie der neuronalen Schaltung des Gehirns
und des analytischen Denkens
ISBN
978-3-00-037458-6
ISBN 978-3-00-042153-2
Monografie von Dr. rer. nat. Andreas Heinrich Malczan
Kapitel 2: Das mehrstufige, parvocellulare System des Gehirns
Gewidmet in ehrendem Gedenken Herrn Professor Rolf Kötter, dessen
außerordentliche Forschungsleistung und dessen hervorragende Beschreibungen der Cytoarchitektonik
des Basalgangliensystems dem Autor die Inspiration und das Faktenwissen lieferte, um die Funktionsweise der Basalganglien aus informationstheoretischer Sicht zu erkennen
Teil 2.1. Das parvocellulare Kletterfasersystem des Gehirns
Im Kapitel 1 wurde das magnocellulare Mittelwertsystem des Gehirns vorgestellt. Es konnte gezeigt werden, dass die Mittelwertsignale der Cortexcluster zur Erzeugung von Kletterfasersignalen genutzt werden. Diese Kletterfasersignale stellen für die Purkinjezellen des Cerebellums den neuronalen Schreibbefehl dar, der zur Abspeicherung des aktuellen Prägungssignals führt. Durch diesen Schreibbefehl wird das Prägungssignal des Cortex zum Eigensignal der Purkinjezelle. Die Eigensignale bilden die Spaltenvektoren der Assoziativmatrix.
Der Inputvektor des Cerebellumclusters besteht aus den Signalen der Signalneuronen des zugehörigen Cortexclusters, die über die Brückenkerne einströmen. Der Output des Cerebellumclusters ist ein Vektor, der sich durch die Multiplikation des Inputvektors mit der Assoziativmatrix ergibt. Seine einzelnen Vektorkomponenten werden von den Outputneuronen der Kleinhirnkerne gebildet. Diese sind genau dann aktiv, wenn die mittlere Stärke des Eigensignals der zugehörigen Purkinjezelle wenigstens die mittlere Signalstärke des aktuellen Fremdsignals erreicht. Dies wird ermöglicht durch das Zusammenspiel der Purkinjezelle mit der zugeordneten Korb- und Sternzelle sowie durch die Einssignalbildung in den Outputneuronen. Die Besonderheit des cerebellaren Systems ist seine Prägungsfähigkeit. Das aus den Aktivitätsneuronen des Cortexclusters abgeleitete Kletterfasersignal "brennt" die Prägungssignale in die Purkinjezellen, Korbzellen, Sternzellen, Golgizellen und Kernneuronen. Dadurch wird dieses Signal zum Eigensignal der Korbzellen, Sternzellen, Golgizellen und Kernneuronen, jedoch zum Fremdsignal für die Purkinjezellen. Während die Fremdsignale die Purkinjezelle erregen, erregen die Eigensignale Korb- und Sternzellen. Letztere hemmen die Purkinjezellen. Je nachdem, welche Signalart überwiegt, reagieren die Outputneuronen verschieden. Daher kann das Kleinhirn als neuronaler Assoziativspeicher mit speziellem Schreibbefehl interpretiert werden.
Da sich zeigen lässt, dass es neben den Kletterfasersignalen, die aus dem magnocellularen Mittelwertsystem abgeleitet werden, weitere Arten von Kletterfasersignalen gibt, müssen wir die verschiedenen Typen von Kletterfasern näher präzisieren.
Definition 2.1: Kletterfasersignale der verschiedenen Systeme
Die Kletterfasern, die vom Output der Mittelwertneuronen (Aktivitätsneuronen) des Cortexcluster abgeleitet werden, bezeichnen wir als Kletterfasern des Mittelwertsystems, als Kletterfasern des magnocellularen Systems oder auch wahlweise als Kletterfasern des Striosomensystems.
Die Kletterfasern, die aus dem Output der Signalneuronen des Cortex abgeleitet werden, bezeichnen wir als Kletterfasern des parvocellularen Systems oder wahlweise als Kletterfasern des Matrixsystems.
Die Kletterfasern, die aus dem Output der Kleinhirnkerne abgeleitet werden, bezeichnen wir als Kletterfasern des cerebellaren Systems.
Die Kletterfasern, die direkt aus den Rezeptorsystemen über die Olive ins Cerebellum projizieren, nennen wir Kletterfasern des spinalen System oder Kletterfasern des Rezeptorsystes.
In diesem Kapitel analysieren wir das Kletterfasersystem des parvocellularen Systems der Cortexcluster.
Doch bevor der Autor das parvocellulare Kletterfasersystem vorstellt, welches in erster Linie der Erzeugung des Kurzzeitgedächtnisses dient und eine der Hauptaufgaben der Basalganglien darstellt, sollen alle Neurologen die Möglichkeit erhalten, die Cytoarchitektonik der Basalganglien aus der Sicht des Autors kennenzulernen.
Die meisten Einsichten zu dieser Thematik verdankt der Autor einerseits Herrn Professor Karl Zilles und andererseits Herrn Professor Rolf Kötter, letzterer war ein begnadeter Schüler von Karl Zilles und hinterließ uns eine ungeheuer exakte und inspirationsstiftende Beschreibung der Cytoarchitektonik der Basalganglien.
Ohne seine detaillierten Beschreibungen der einzelnen Substrukturen und deren genauer Cytoarchitektonik wäre diese Monografie niemals entstanden.
Ausgangspunkt ist eine grafische Darstellung des Basalgangliensystems nach Young und Penney aus dem Jahre 2000, die in der sehr lesenswerten Dissertation von Inka Eisfeld aufgefunden wurde. Das Besondere an dieser Darstellung ist, dass auch der Nucleus pedunculopontinus mit seinen acetylcholinergen Projektionen einbezogen wurde und alle wichtigen Projektionswege enthalten sind, die in anderen Darstellungen oft fehlen.
Der Leser möge die Wiedergabe der Darstellung als "Bildzitat" verstehen, das im Rahmen einer wissenschaftlichen Arbeit auch ohne ausdrückliche Zustimmung der Urheber möglich sein sollte.
Bildzitat: Basalganglienschema nach Young und Penney:
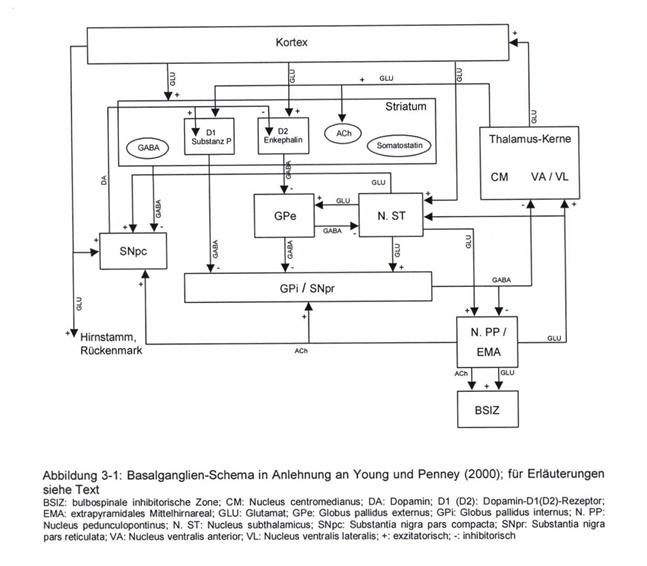
Diese Darstellung war Ausgangspunkt einer wissenschaftlichen Auseinandersetzung, in deren Ergebnis der Autor das Basalgangliensystem in zwei Subsysteme aufteilte:
das magnocellulare Striosomensystem der Basalganglien
das parvocelulare Matrixsystem der Basalganglien.
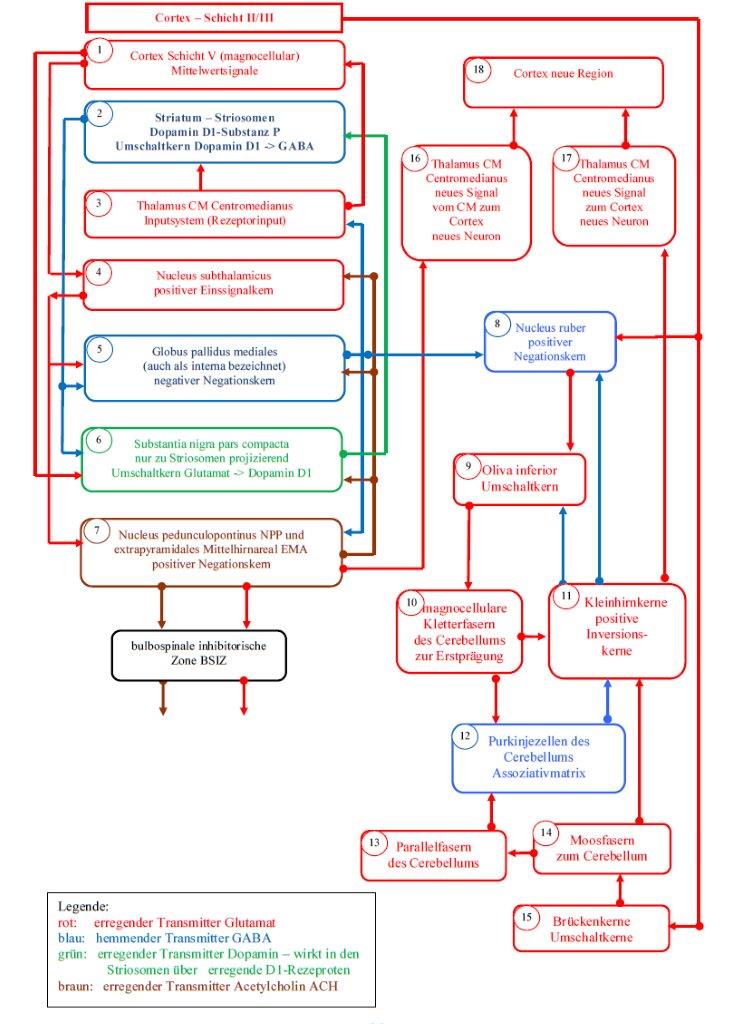
Skizze 2.1: Basalganglien-Modell des Striosomen-Subsystems nach Andreas Heinrich Malczan
Skizze 2.2: Basalganglien-Modell des Matrix-Subsystems nach Andreas Heinrich Malczan
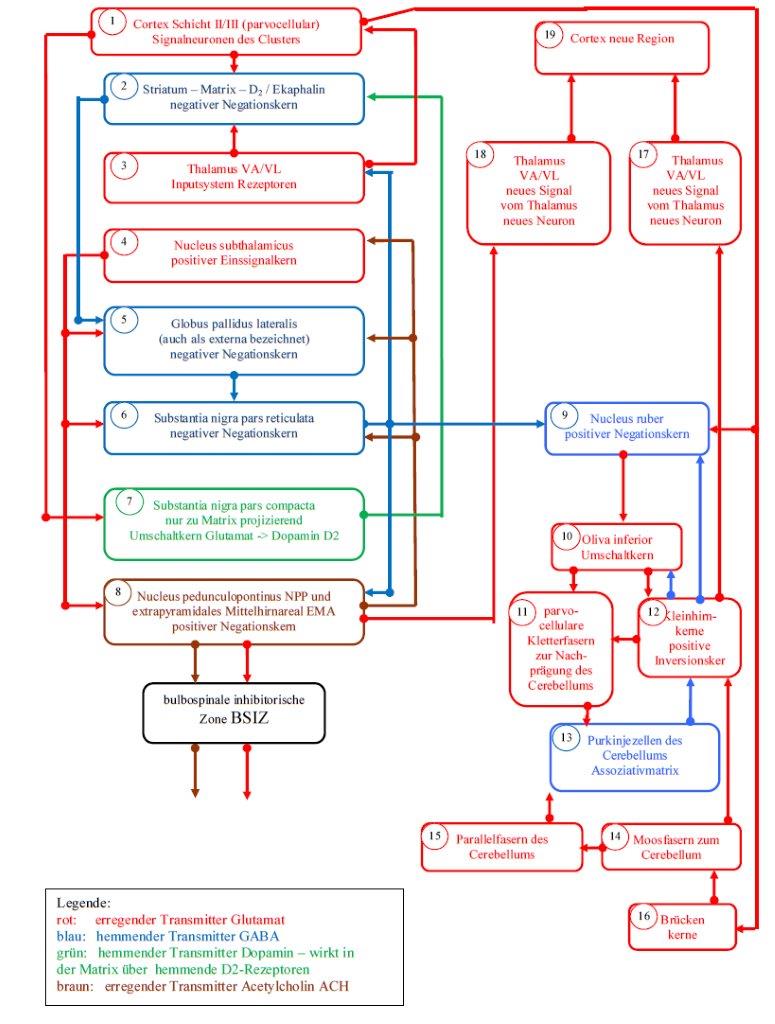
Die Darstellungen des Striosomensystems und des Matrixsystems sind als Flussbilder organisiert, zur Erleichterung der Erklärung sind die Subelemente beschriftet und mit kleinen Nummern versehen, die sich innerhalb der kleinen Kreise befinden. Die verschiedenen Farben stellen die verschiedenen Transmitter dar, die in der zugehörigen Legende jeweils präzisiert werden.
Der Nachweis, dass die vom Autor dargestellten strukturellen und systemtheoretischen Zusammenhänge realitätsnah sind, benutzt in erster Linie die von Professor Rolf Kötter dargestellten Einsichten.
An dieser Stelle sei noch einmal angedeutet, dass der Autor dieser Monografie Mathematiker ist. Er wendet in seiner Theorie die Erkenntnisse an, die sich tausende Neurologen in zähem Bemühen selbst erarbeitet haben.
Die nachfolgenden Aussagen in diesem Abschnitt beruhen größtenteils auf einem Skript von Prof. Dr. Rolf Kötter, welches unter der Internetadresse
https:/www.hirn.uni-duesseldorf.de/~rk/Taeching/lect_bg.htm
beziehungsweise unter
https://www.anatomie.net/Unterricht/Skripte/lect_bg.htm
verfügbar sind (im Juli 2011).
Doch zunächst rekapitulieren wir zur Erinnerung das Theorem 1.2 dieser Monografie und geben es nochmals (als Theorem 2.1) wieder:
Theorem 2.1: Die Substantia nigra pars compacta ist ein Umschaltkern für den Cortexoutput
Die Substantia nigra pars compacta erhält einerseits den Output der Signalneuronen des Cortexclusters und andererseits den Output der Aktivitätsneuronen. Beide Arten von Output sind glutamaterg und werden auf den Transmitter Dopamin umgeschaltet. Während die Clusterneuronen auf Dopamin vom Subtyp D2 umgeschaltet werden und ihre Zielneuronen in der Matrix des Striatums hemmen, werden die Aktivitätsneuronen der Cortexcluster auf Dopamin vom Subtyp D1 umgeschaltet und wirken auf ihre Zielneuronen in den Striosomen des Striatums erregend.
In Bezug auf das Matrixsystem behauptet das Theorem 2.1, dass die Signalneuronen eines jeden Cortexclusters zur Substantia nigra ziehen und dort auf Dopamin vom Subtyp D2 umgeschaltet werden. Dabei durchziehen die Axone der Signalneuronen das neuronale Kerngebiet des Striatums, so dass ihre Erregung dort zur Verfügung steht.
Die Axone der Substantia nigra pars compacta ziehen zurück in Richtung Cortex, enden aber vorher im Kerngebiet des Striatums. Dieses besteht aus zwei räumlich gut zu trennenden Subsystemen. Ein Subsystem sind die Striosomen, das andere die Matrix.
Hierbei sollte man sich vorstellen, dass die Striosomen kleine Raumgebiete darstellen, die in die Matrix eingebettet sind, ähnlich wie Rosinen in einen Kuchen. Beide Subsysteme unterscheiden sich durch die Rezeptoren ihrer Synapsen. In den Striosomen wirkt das Dopamin über D1-Rezeptoren erregend. In der Matrix dagegen wirkt es vermittels der D2-Rezeptoren hemmend.
Die gehemmten Neuronen des Striatums werden in der Literatur zu Recht als Hauptneuronen bezeichnet. Im Werk �Funktionelle Neuroanatomie� von Karl Zilles und Gerd Rehkämper lesen wir auf Seite 278 der dritten Auflage:
(Zitatbeginn)
"Die striatalen Zielzellen des Tractus corticostriatalis sind mittelgroße Neurone (Somadurchmesser 15 µm), die mehr als 70 % der Nervenzellen im Corpus striatum stellen und daher als Hauptneurone bezeichnet werden. Ihre Dendriten sind dicht mit Dornen, Spines, besetzt und jedes Hauptneuron empfängt tausende verschiedener kortikaler Axone. Hauptneurone zeigen meist wenig elektrische Aktivität, da sie nur dann Aktionspotentiale bilden, wenn viele Afferenzen an ihren Dendriten etwa gleichzeitig aktiv sind. Wenn sie jedoch Aktionspotentiale bilden, wirken sie inhibitorisch auf ihre Zielneuronen durch Freisetzung des Transmitters GABA."
(Zitatende)
Wir erinnern uns an die Definition 1.14 des negativen Negationskerns mit interner Einssignalbildung. Daher unterstellen wir die folgenden Annahmen:
- Die Hauptneuronen der Matrix des Striatums sind Einssignalneuronen. Sie zapfen den vorbeiziehenden und erregenden Cortexoutput an, wozu sie riesige Dendritenbäume bilden. Eine mögliche reine Mittelwertbildung kann ausgeschlossen werden, da aus-drücklich von tausenden vorbeiziehenden erregenden Axonen gesprochen wird. Das Einssignal ist negativ, weil die Hauptneurone GABAerg sind.
- Die Hauptneurone bilden also ein negatives Einssignal, welches von den Axonen des nigrostriatalen Inputs gehemmt wird. Dies ist ein typisches Kennzeichen von Nega-tionskernen.
- Negiert wird also jedes D2-dopaminerge Signal aus der Substantia nigra pars compacta.
- Da der Output der Neuronen der Substantia nigra pars compacta vom Subtyp D2 von den Signalneuronen des Cortex kommend auf Dopamin umgeschaltet wird, wird also letztlich der Cortexoutput der Signalneuronen in der Matrix des Striatums negiert.
Daher gilt nachfolgende Erkenntnis des Autors.
Theorem 2.2: Die Matrix des Striatums ist ein negativer Negationskern mit interner Einssignalbildung
Die Matrix des Striatums ist ein negativer Negationskern für den Output der Signalneuronen der Cortexcluster. Dieser wird zunächst vom Cortex kommend zur Substantia nigra pars compacta geleitet und dort auf Dopamin vom Subtyp D2 umgeschaltet. Nach der Umschaltung hemmt er die einssignalbildenden Hauptneuronen der Matrix, wodurch dieser Cortexoutput negiert wird. Da die Hauptneurone das negierte Signal vermittels GABA weitergeben, ist die Matrix ein negativer Negationskern. Eine interne Einssignalbildung liegt vor, weil das Einssignal vom durchziehenden Cortexoutput abgeleitet wird.
Später wird sich zeigen, dass die nachgewiesene Verbindung zwischen Matrix und Striosomen durch den Transmitter Acetylcholin (ACH) eine wichtige Bedeutung bei der Aufmerksamkeitssteuerung hat.
In Skizze 2.2 sieht man, dass der Output der Matrix (2) zunächst zum Globus pallidus lateralis (5) zieht, der in der Literatur auch als auch pallidus externa bezeichnet wird. Dieses Kerngebiet empfängt jedoch gleichzeitig Input vom Nucleus subthalamicus (4). Aufgezeigt wurde, dass der Nucleus subthalamicus nach Theorem 1.4 ein positiver Einssignalkern ist.
Ein Gebiet, welches einerseits erregenden Einssignalinput und hemmenden Input erhält und nur hemmenden Output erzeugt, kann aller Wahrscheinlichkeit nach nur ein negativer Negationskern sein. Eine andere Möglichkeit wäre ein Inversionskern.
Da aber der Output des Globus pallidus externa nicht ständig aktiv ist � was bei einem Inversionskern zuträfe � bleibt nur der Negationskern übrig. Somit formulieren wir ein neues Theorem.
Theorem 2.3: Der Globus pallidus externa ist ein negativer Negationskern für den GABAergen Output der Matrix des Striatums
Der Globus pallidus externa ist ein negativer Negationskern mit externer Einssignalbildung. Das positive Einssignal entstammt dem Nucleus subthalamicus. Der Output des Globus pallidus externa ist der doppelt negierte Output der Signalneuronen der Cortexcluster. Da der Output hemmend ist, liegt ein negativer Negationskern vor.
Nachdem der Output der Signalneuronen eines Clusters erstmalig in der Matrix des Striatums negiert wurde, wird er nun nochmals im Globus pallidus externa negiert. Dadurch entsteht einerseits eine Zeitverschiebung der Cortexsignale, da die Aktionspotentiale einen beträchtlichen Weg zurücklegen müssen. Andererseits entsteht dadurch eine Frequenzverschiebung, wobei die ursprüngliche Feuerrate der Cortexneuronen auf ein mittleres Signalniveau angehoben oder auch abgesenkt wird. Letzteres hat die Ursache in den erzeugten Einssignalen.
In Skizze 2.2 erkennt man, dass der Output des Globus pallidus externa (5) zur Substantia nigra pars reticulata (6) geleitet wird. Jene empfängt jedoch wiederum den Einssignalinput aus dem Nucleus subthalamicus (4).
Mit gleicher Argumentation folgt, dass die Substantia nigra pars reticulata ebenfalls ein negativer Negationskern mit externem Einssignal ist.
Der Output dieses Kerns zieht zum Nucleus ruber (9). Von diesem wurde bereits gezeigt, dass er ein positiver Negationskern ist. Daher gelten nachfolgende zwei Theoreme:
Theorem 2.4: Die Substantia nigra pars reticulata ist ein negativer Negationskern für den GABAergen Output des Globus pallidus externa
Die Substantia nigra pars reticulata ist ein negativer Negationskern mit externer Einssignalbildung. Das positive Einssignal entstammt dem Nucleus subthalamicus. Der Output der Substantia nigra pars reticulata ist der dreifach negierte Output der Signalneuronen der Cortexcluster. Da der Output hemmend ist, liegt ein negativer Negationskern vor.
Theorem 2.5: Der Nucleus ruber ist ein positiver Negationskern für den GABAergen Output der Substantia nigra pars reticulata
Der Nucleus ruber ist ein positiver Negationskern mit interner Einssignalbildung. Das positive Einssignal wird im Nucleus ruber selbst gebildet. Dazu wird der vom Cortex stammende magnocellulare Output der Mittelwertneuronen (Aktivitätsneuronen) des Cortexclusters genutzt, wodurch der magnocellulare Anteil des Nucleus ruber entsteht. Das positive Einssignal wird vom Output der Substantia nigra pars reticulata gehemmt und erzeugt als Output die Negation der Signale aus der Substantia nigra pars reticulata. Da der Output erregend ist, liegt ein positiver Negationskern vor.
Damit wird der Output eines jeden Signalneurons des Cortexclusters insgesamt vier Mal negiert:
- erstmalig in der Matrix des Striatums (negativer Negationskern)
- zum zweiten Mal im Globus pallidus externa (negativer Negationskern)
- drittens in der Substantia nigra pars reticulata (negativer Negationskern)
- viertens im Nucleus ruber (positiver Negationskern).
Vom Nucleus ruber ziehen die signalführenden Axone zur Oliva inferior, geben wie üblich Kollateralaxone zu den betreffenden Kleinhirnkernen ab und erreichen die Purkinjezellen als Kletterfasern.
Daher gilt nachfolgende Erkenntnis:
Theorem 2.6: Der Output der Signalneuronen eines Cortexclusters erreicht vierfach negiert, zeitverzögert und frequenztransformiert als Kletterfasersignal die Purkinjezellen des zugehörigen Cerebellumclusters
Die Signale der Signalneuronen eines Cortexclusters werden vom Matrixsystem der Basalganglien vierfach negiert und zu Kletterfasersignalen transformiert, wobei sie um eine beachtliche Zeitdifferenz verzögert werden.
Das Cerebellum besitzt also von jedem prägungsfähigem Signal der Cortexrinde eines Cortexclusters zwei Varianten:
- eine Moosfaservariante, die als direkte Variante bezeichnet werden könnte, und bei der die Cortexsignale mit sehr geringer Zeitverzögerung über die Brückenkerne die Moosfasern erreichen, die sowohl die Neuronen der Cerebellumkerne versorgen als auch über die Körnerzellen die Parallelfasern erregen
- eine Kletterfaservariante, die als indirekte Variante bezeichnet werden könnte. Die Cortexsignale erreichen hier mit größerer Zeitverzögerung über die Substantia nigra pars compacta, die Matrix des Striatums, den Globus pallidus externa, die Substantia nigra pars reticulata, den Nucleus ruber und den Nucleus olivaris inferior letztlich die Kleinhirnkerne und die Kletterfasern des Matrixsystems.
Nun ist es an der Zeit, die Größe der Zeitverzögerung abzuschätzen, die den Cortexsignalen durch das Matrixsystem aufgeprägt wird. Hier erinnern wir uns an das Theorem 1.13. Es besagte unter anderem, dass der Systemtakt im Striosomensystem etwa 5 Hz beträgt. Diese Feststellung wird gestützt durch die Aussagen von Karl Zilles und Gerd Rehkämper über die lose Kopplung der Neuronen der Substantia nigra pars compacta durch dendrodendritische Synapsen.
In den Abbildungen auf Seite 31 sieht man in der "Zeitlupendarstellung", dass das Aktionspotential für einen kompletten Schleifendurchlauf 100 ms benötigt, woraus sich die Taktdauer von 200 ms und eine Taktfrequenz von 5 Hz ableiten.
Wenn ein kompletter Schleifendurchlauf 100 ms dauert, so braucht ein Signal vom Cortex zur Substantia nigra pars compacta ca. 50 ms, von dort wiederum 50 ms bis zum Striatum, und evtl. noch geschätzte 25 ms für die vierfache Negation.
Damit wären 125 ms ausreichend für die Strecke vom Cortex bis zur Purkinjezelle. Dieses entspräche dem Wert von 1/8 Sekunde.
Es bleibt allen Neurologen unbenommen, diese vom Autor geschätzte Zahl durch exakte Messungen zu korrigieren. Wir fassen dieses geschätzte Ergebnis in einem eigenen Theorem zusammen.
Theorem 2.7: Zeitverzögerung der Cortexsignale durch das Matrixsystem
Die Zeitverzögerung der Signale der Signalneuronen des Cortex durch das Matrixsystem der Basalganglien auf ihrem Weg zu den Purkinjezellen des Cerebellums beträgt geschätzt etwa 125 Millisekunden. Erst nach dieser Zeitverzögerung trifft das Signal eines Signalneurons aus dem zugehörigen Cortexcluster als Kletterfasersignal bei der zugehörigen Purkinjezelle ein.
In der Skizze 2.1, aber auch Skizze 2.2 gibt es noch den Neuronenkern namens Nucleus pedunculopontinus (NNP), dessen Aufgaben bisher nicht angesprochen wurden. Dies ist nun nachzuholen.
- ← Teil 1.7. Die Erzeugung des (magnocellularen und primären) Kletterfasersignals ...
- Teil 2.2. Die Rolle des Nucleus pedunculopontinus im Basalgangliensystem →
ISBN
978-3-00-037458-6
ISBN 978-3-00-042153-2
Monografie von Dr. rer. nat. Andreas Heinrich Malczan